海院科研动态(123)| 精氨酸琥珀酸合酶介导的氰基合成的结构基础与作用机制
氰基(C≡N)因其在药物分子设计中具有独特的电子效应和反应活性,常被用于开发新型共价抑制剂。然而,迄今为止在天然产物中报道的含氰基化合物仍然非常有限,其生物合成途径和分子机制也尚不清楚,这极大地限制了相关天然产物在药物先导分子开发中的应用潜力。因此,深入解析天然产物中氰基的形成机制,不仅有助于拓展我们对天然化学结构多样性的认识,还为未来的基因组挖掘与酶工程改造提供了理论依据和实践价值。
近期,我院海洋天然产物研究团队联合中科院青岛生物能源与过程研究所,对海洋来源真菌Penicillium auranthiogriseum SYSU-MS299中的auranthine生物合成基因簇进行分析,首次揭示了其包含氰基合成酶ArtA和两模块NRPS基因ArtB。通过异源表达实验,证实了ArtA和ArtB是合成auranthine的核心酶,ArtA负责合成L-γ- cyanohomoalanine(γ-CHA)前体,而ArtB则将其加入到合成线路中。通过进一步的研究发现,ArtB在缺乏特定底物时会表现出底物广泛性,从而产生含氰基氨基酸的替代产物(图1)。
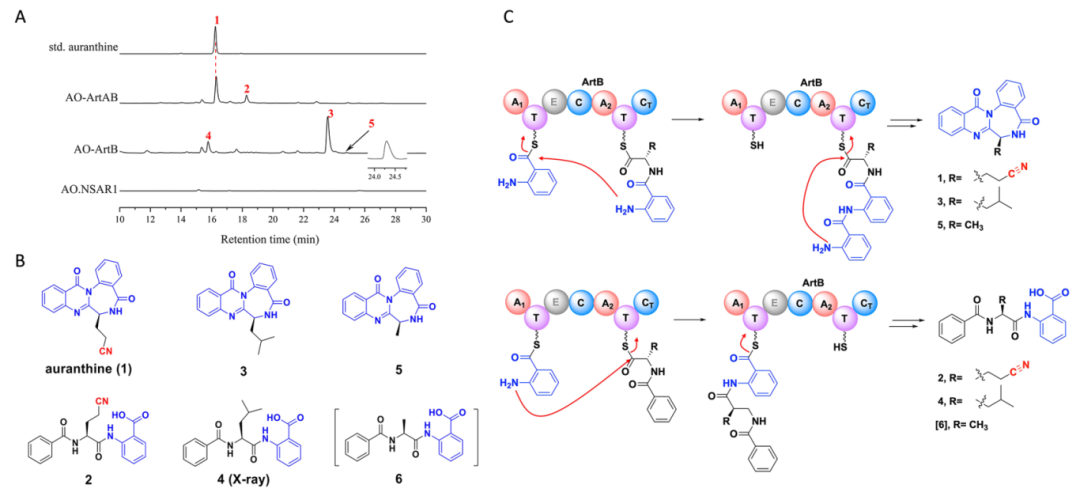
图1:通过异源表达对art基因簇进行功能表征
为了进一步验证ArtA的功能,团队成员表达并纯化了ArtA,发现其在ATP依赖下能够催化L-谷氨酰胺形成Fmoc-L-γ-氰基同脯氨酸。通过同位素标记实验,确认了氰基的氮源来自谷氨酰胺的侧链酰胺。此外,ArtA对底物的选择性非常严格,只有谷氨酰胺能够与其结合并催化生成氰基(图2)。ArtA与已知的ASS(天冬氨酸琥珀酸合成酶)具有42%的序列相似性,且其结构域和功能上的重要残基也与ASS高度相似。通过对ArtA同源物的序列相似性网络分析,发现该酶家族广泛分布于真菌和细菌中,并推测真菌可能通过水平基因转移(HGT)获得了这一强大的合成能力。研究人员通过对ArtA晶体结构的解析,发现其呈四聚体形式,并且ATP结合区域和ASS具有相似的结构特点。晶体学的研究还揭示了ArtA在催化过程中通过ATP诱导的结构变化,促进了其对L-谷氨酰胺的结合及催化反应(图3)。进一步的分子动力学模拟和定点突变实验支持了ArtA通过其活性位点与谷氨酰胺的酰胺基团进行亲核攻击,从而完成氰基的形成(图4)。
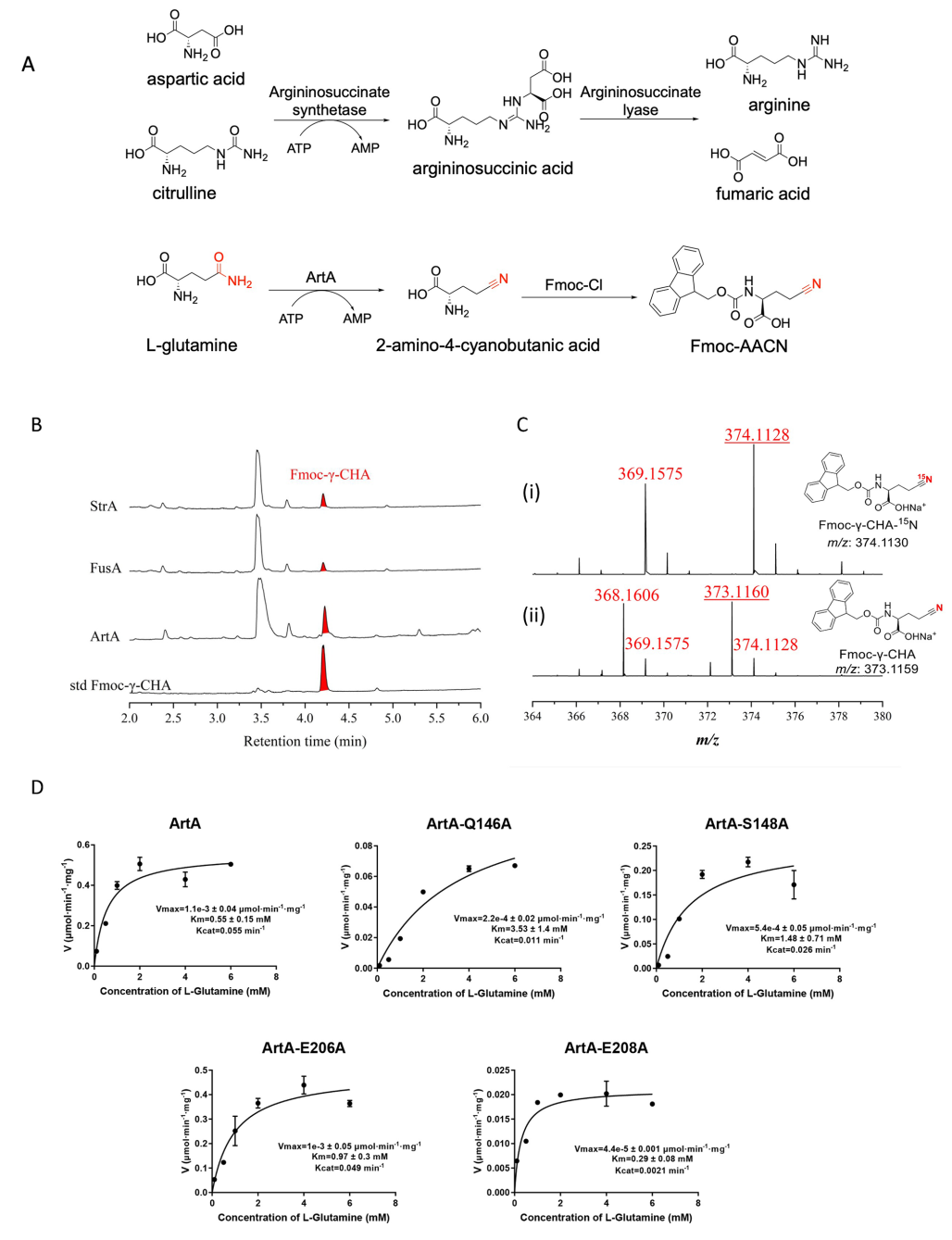
图2:ArtA的生化特征揭示了氰基氨基酸生物合成途径
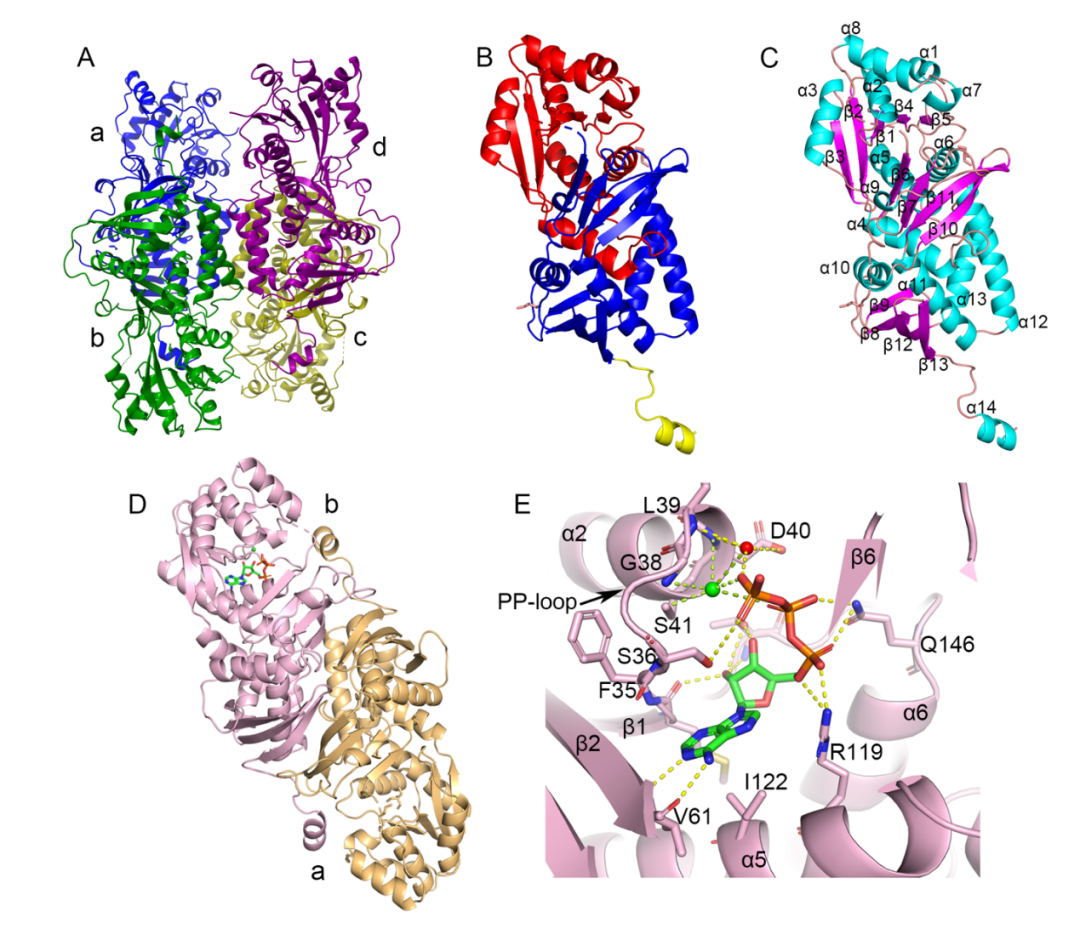
图3: ArtA和ArtA_ATP复合物的结构分析
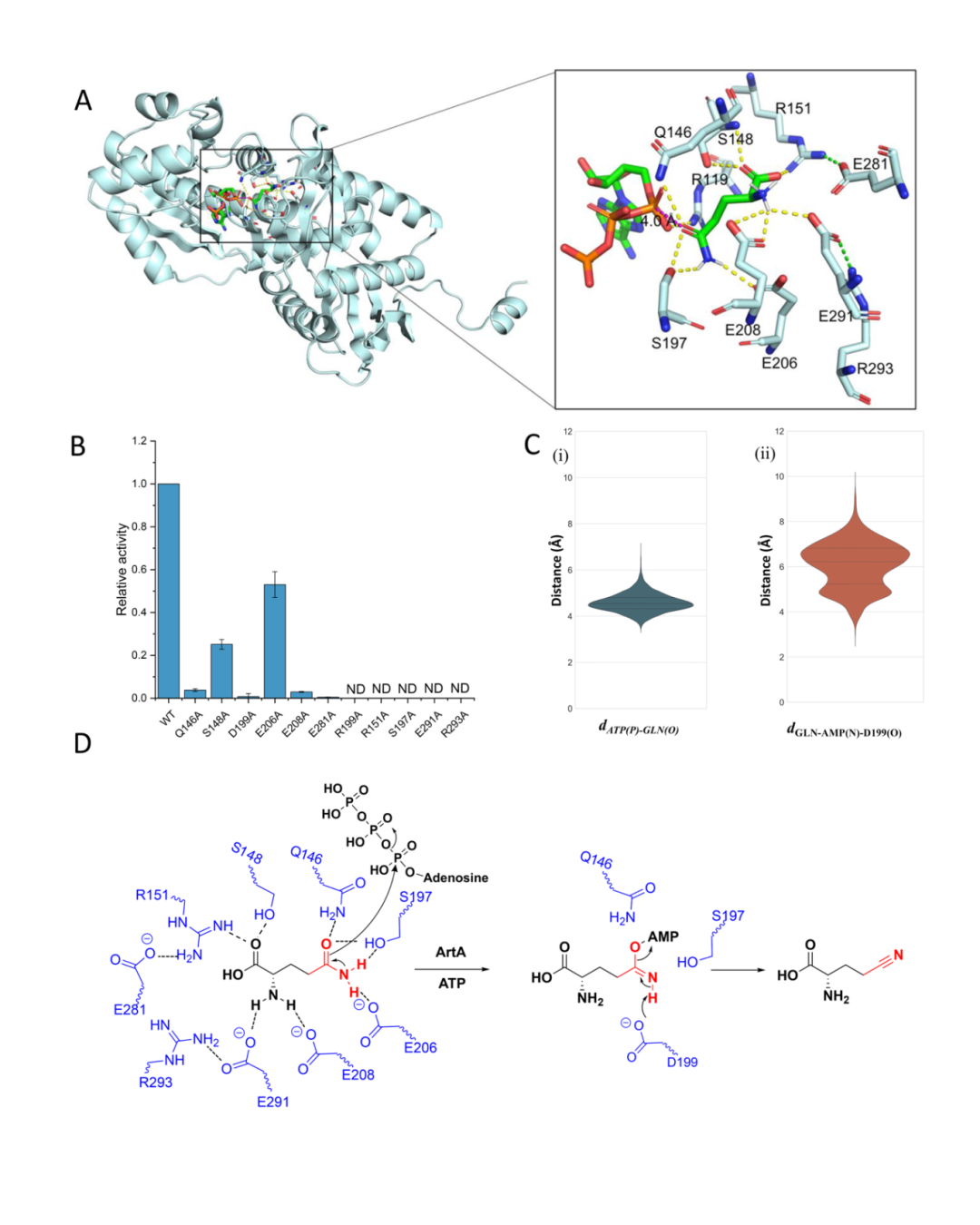
图4:ArtA的结构和机制解析
总体而言,本研究为ArtA的结构和催化机制提供了深刻的见解,不仅揭示了氰基在海洋天然产物中的生物合成途径,还为后续的基因组挖掘和生物催化剂的工程化提供了宝贵的分子蓝图。
上述成果发表于生物工程领域的权威期刊《ACS Catalysis》(中科院大类一区Top期刊,IF= 13.1)上,(Yujing Zeng§, Keke Zhang§, Tiantian Lu§, Xinjian Yin, §, Qiang Wang, Longwei Xiong, Heng Guo, Jing Li, Xuefeng Lu,Lan Liu*,Honglei Ma *, and Zhizeng Gao*, Structural and Mechanistic Basis for Nitrile Synthetase by an Argininosuccinate Synthetase-Like Enzyme, ACS Catal, 2025, 15: 16254-16267.)。论文第一作者为我院硕士毕业生曾煜晶,博士研究生卢甜甜、尹新坚副研究员以及中科院青岛生物能源与过程研究所的张柯柯助理研究员,我院高志增教授、刘岚教授和中科院青岛生物能源与过程研究所的马洪磊研究员为本文共同通讯作者。
本研究得到了国家重点研发计划项目(2022YFC2805000)、国家自然科学基金(32370056和32271358)、山东泰山奖学金、山东省实验室项目(LZR202211060073)、山东省自然科学基金项目(ZR2024QC065)、南方海洋科学与工程广东省实验室(珠海)(编号SML2021SP319)和广东省海洋经济发展专项(编号GDNRC[2022]35)的支持。
文章链接:
https://pubs.acs.org/articlesonrequest/AOR-QJTJSZPIW2276QEZJX 8E



